La science de l’arthrosamide® (2.5 iPAAG)
Redéfinir le traitement de l’arthrose du genou, sans chirurgie.

Redéfinir le traitement de l’arthrose du genou, sans chirurgie.

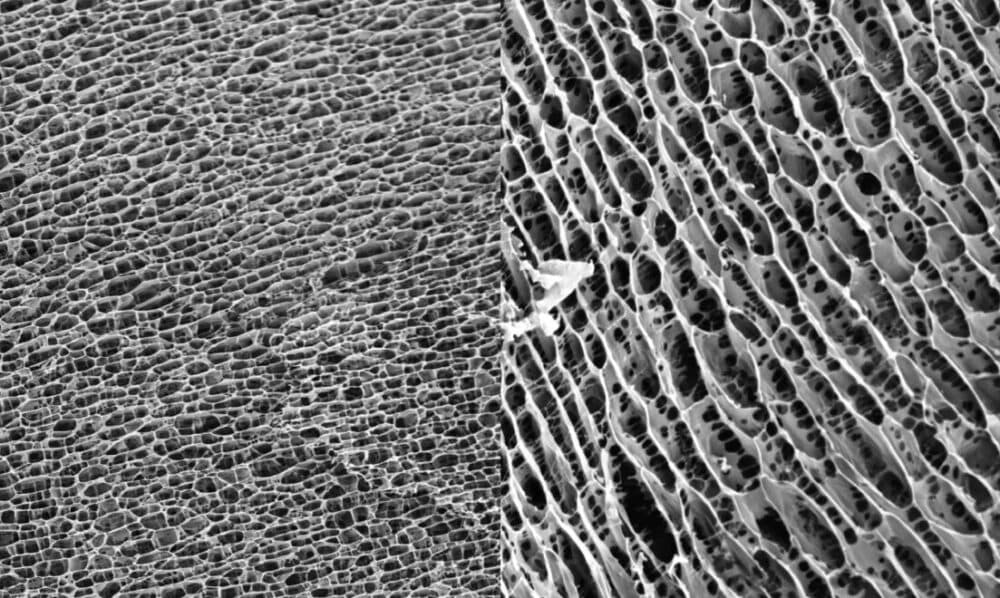
L’arthrosamide® est un gel hydrophile non absorbable, non biodégradable, injectable, transparent et composé d’un squelette de polyacrylamide (2,5 %) fermement lié et non biodégradable et d’eau apyrogène attachée (97,5 %)
Arthrosamid® est fourni sous forme de seringue stérile de 1 mL préremplie à usage unique, scellée par un raccord Luer Lock et un capuchon d’embout. Il est destiné à être injecté intra-articulaire dans l’articulation du genou avec une aiguille stérile de 21G x 2 pouces (0,8 x 50 mm).
| La figure 1 montre la structure tridimensionnelle de l’hydrogel de polyacrylamide. La structure en nid d’abeille uniforme et serrée fournit une matrice pour la croissance cellulaire. |
Graphique 2

Graphique 3

Arthrosamid® n’incorpore pas de substance médicinale, de tissus ou de produits sanguins.
Sur la base des tests effectués, l’arthrosamide® est considéré comme biocompatible et adapté au contact à long terme avec le corps.
Matériaux utilisés dans Arthrosamid®

Biocompatibilité d'Arthrosamid®

La stabilité des hydrogels de polyacrylamide de Contura est décrite et discutée en détail dans le Rapport d’évaluation biologique (BER) – Arthrosamide®, et un résumé des essais de stabilité portant sur l’hydrolyse, le stress oxydatif et le stress physique potentiels sur l’hydrogel B est présenté ci-dessous (tableau 5). Comme il a été examiné dans le BER, la dégradation enzymatique du polyacrylamide a été testée dans divers systèmes de fermentation enzymatique, mais aucune dégradation n’a été observée.
On constate que l’hydrogel de polyacrylamide est stable et ne se dégrade pas dans les conditions d’essai.
Afficher les résultats de stabilité et de durée de vie

Stabilité et durée de vie d'Arthrosamid®
Comme nous l’avons décrit dans la présente section et dans les sections précédentes, des études précliniques ont montré que l’arthrosamide®/« hydrogel » est biocompatible, non absorbable, non biodégradable et non migrateur (Bello et coll., 2007 ; Charles River, 2011 ; Zarini et al., 2004). Des données cliniques à long terme l’ont confirmé (Mouritsen et coll., 2014 ; Negredo et al., 2015). Il est donc raisonnable de conclure qu’Arthrosamid® est stable et sûr pendant toute la durée de vie du dispositif.
L’objectif de l’arthrosamide® est résumé ci-dessous :
| Objectif de l’arthrosamide® | |
|---|---|
| Indication | L’arthrosamide® est destiné au traitement symptomatique de l’arthrose du genou chez l’adulte. |
| Maladie à traiter | Arthrose du genou. |
| Population de patients | Patients adultes diagnostiqués avec de l’arthrose. |
| Application prévue | L’arthrosamide® est destiné à être injecté intra-articulaire dans l’articulation du genou. |
| Utilisateur visé | L’arthrosamide® est destiné à être utilisé par un médecin qualifié familier avec les procédures d’injection intra-articulaire, comme les chirurgiens orthopédistes ou les rhumatologues. |
| Effet sur le corps humain | L’arthrosamide® diminue la douleur et améliore la fonction du genou affecté par l’arthrose. |
| Tissus en contact avec l’appareil | Articulation du genou. |
| Durée d’utilisation | Longue durée (>30 jours). |
| Contact avec les muqueuses | L’arthrosamide® est en contact avec la membrane synoviale de l’articulation du genou. |
| Invasif / non invasif | Envahissant. |
| Implantable / non implantable | Implantable. |
| Usage unique / réutilisable | À usage unique. |
| Dose recommandée | 6 ml. |
| Contre-indications | Arthrosamid® ne doit pas être injecté :
|
| Avertissements |
|
| Précautions requises par le fabricant |
|
Tableau 6. Objectif prévu d'Arthrosamid®. Des données de suivi clinique à douze mois sont présentées pour Arthrosamid® (voir 5.4.1 et 5.4.4), tandis que des données cliniques à long terme sont disponibles pour les hydrogels de Contura pour d’autres indications jusqu’à 8 ou 10 ans (3.1.2.10), et il est donc raisonnable de croire que cet implant/hydrogel permanent est stable et sûr pendant toute la durée de vie du dispositif (3.1.2.10).La posologie recommandée de 6 ml est basée sur le volume total de gel injecté dans l’étude de « preuve de concept » ( 2 x 3 ml pour la majorité (96%) des patients) et sur les données de l’étude CON-OA (5.4.4). Une injection de 6 ml par rapport à 2 x 3 ml réduit le risque d’infection, et les antibiotiques prophylactiques ne sont administrés qu’une seule fois.
Pionnier et éprouvé traitement de la douleur pour l’arthrose du genou.
Contactez-nous pour utiliser Arthrosamid® chez vos patients souffrant d’arthrose du genou dès aujourd’hui.