A Ciência da Artrosamida® (2.5 iPAAG)
Redefinindo o tratamento para OA de joelho, sem cirurgia.

Redefinindo o tratamento para OA de joelho, sem cirurgia.

A artrosamida® é um gel hidrofílico não absorvível, não biodegradável, injetável, transparente, constituído por uma espinha dorsal de poliacrilamida firmemente ligada, não biodegradável (2,5%) e água não pirogénica ligada (97,5%)
A artrosamida® é fornecida como uma seringa de 1 ml, pré-cheia de utilização única, estéril, de 1 ml, selada com um encaixe Luer Lock e uma cápsula de fecho na ponta. Destina-se a ser injetado intra-articularmente na articulação do joelho com uma agulha estéril de 21G x 2 polegadas (0,8 x 50mm).
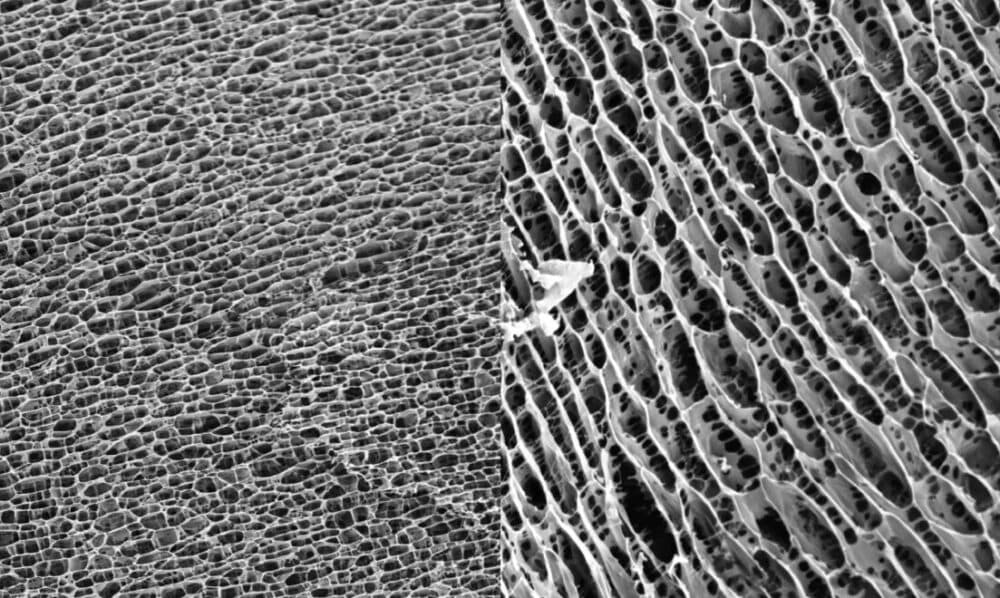
| A Figura 1 mostra a estrutura tridimensional do hidrogel de poliacrilamida. A estrutura uniforme e apertada do favo de mel fornece uma matriz para o crescimento celular. |
Gráfico 2

Gráfico 3

A artrosamida® não incorpora uma substância medicamentosa, tecidos ou produtos derivados do sangue.
Com base nos testes realizados, Arthrosamid® é considerado biocompatível e adequado para o contato a longo prazo com o corpo.
Materiais utilizados na artrosamida®

Biocompatibilidade da artrosamida®

A estabilidade dos hidrogéis de poliacrilamida da Contura é descrita e discutida extensivamente no Relatório de Avaliação Biológica (RIC) – Artrosamida®, e um resumo dos testes de estabilidade que investigam a hidrólise potencial, o estresse oxidativo e físico no "Hidrogel B" é apresentado abaixo (Tabela 5). Conforme revisado no RIC, a degradação enzimática da poliacrilamida foi testada em vários sistemas de fermentação enzimática, mas nenhuma degradação foi observada.
Observa-se que o hidrogel de poliacrilamida é estável e não se degrada nas condições de ensaio.
Ver resultados de estabilidade e tempo de vida

Estabilidade e vida útil da artrosamida®
Tal como descrito nesta e nas secções anteriores, estudos pré-clínicos demonstraram que a Arthrosamid®/"Hydrogel" é biocompatível, não absorvível, não biodegradável e não migratória (Bello et al., 2007; Rio Carlos, 2011; Zarini et al., 2004). Dados clínicos de longo prazo confirmaram isso (Mouritsen et al., 2014; Negredo et al., 2015). É, portanto, razoável concluir que Arthrosamid® é estável e seguro durante a vida útil do dispositivo.
O objetivo pretendido de Arthrosamid® é resumido abaixo:
| Finalidade pretendida da Artrosamida® | |
|---|---|
| Indicação | Arthrosamid® destina-se a ser utilizado para o tratamento sintomático da osteoartrite do joelho em adultos. |
| Doença a tratar | Osteoartrite do joelho. |
| População de doentes | Doentes adultos diagnosticados com osteoartrite. |
| Aplicação pretendida | Arthrosamid® destina-se a ser injetado intra-articularmente na articulação do joelho. |
| Utilizador pretendido | Arthrosamid® destina-se a ser usado por um médico qualificado familiarizado com procedimentos de injeção intra-articular, tais como cirurgiões ortopédicos ou reumatologistas. |
| Efeito no corpo humano | A artrosamida® diminui a dor e melhora a função do joelho afetado pela osteoartrite. |
| Tecidos em contacto com o dispositivo | Articulação do joelho. |
| Duração da utilização | Longo prazo (>30 dias). |
| Contacto com membranas mucosas | A artrosamida® está em contacto com a membrana sinovial da articulação do joelho. |
| Invasivo/não invasivo | Invasivo. |
| Implantável / não implantável | Implantável. |
| Utilização única / reutilizável | Utilização única. |
| Dose recomendada | 6 ml. |
| Contraindicações | A artrosamida® não deve ser injetada:
|
| Advertências |
|
| Precauções exigidas pelo fabricante |
|
Tabela 6. Finalidade da Arthrosamid®. São apresentados dados de acompanhamento clínico de doze meses para a artrosamida® (ver 5.4.1 e 5.4.4), enquanto que estão disponíveis dados clínicos a longo prazo para os hidrogéis de Contura para outras indicações até 8 ou 10 anos (3.1.2.10), pelo que é razoável acreditar que este implante/hidrogel permanente é estável e seguro durante toda a vida útil do dispositivo (3.1.2.10).A dose recomendada de 6 ml baseia-se no volume total de gel injetado no estudo de "prova de conceito" ( 2 x 3 ml para a maioria (96%) dos pacientes) e nos dados do estudo CON-OA (5.4.4). Uma injeção de 6 ml em comparação com 2 x 3 ml reduz o risco de infeção e os antibióticos profiláticos só são administrados uma vez.
Tratamento pioneiro e comprovado da dor para OA do joelho.
Contate-nos para usar Arthrosamid® em seus pacientes com osteoartrite do joelho hoje.