The Science of Arthrosamid® (2.5 iPAAG)
Redefining treatment for knee OA, without surgery.

Redefining treatment for knee OA, without surgery.

Arthrosamid® is a non-absorbable, non-biodegradable, injectable, transparent, hydrophilic gel consisting of a backbone of firmly bound, non-biodegradable polyacrylamide (2.5%) and attached non-pyrogenic water (97.5%)
Arthrosamid® is supplied as a pre-filled, single use, sterile, 1 mL syringe, sealed with a luer lock fitting and a tip cap. It is intended to be injected intra-articularly in the knee joint with a sterile 21G x 2 inches (0.8 x 50mm) needle.
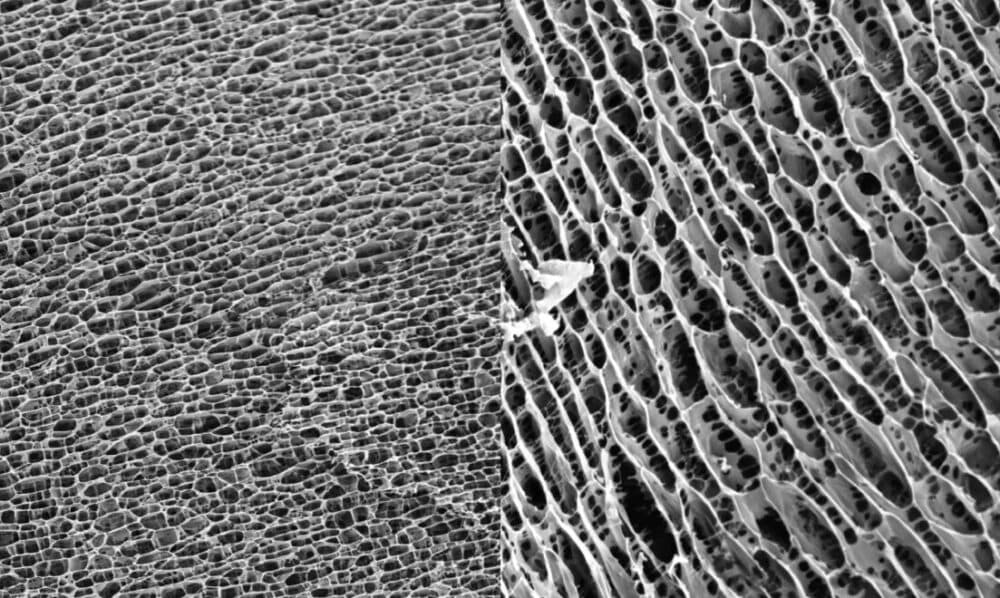
| Figure 1 shows the three-dimensional structure of the polyacrylamide hydrogel. The tight uniform honeycomb structure provides a matrix for cell ingrowth. |
Figure 2

Figure 3

Arthrosamid® does not incorporate a medicinal substance, tissues or blood products.
Based on the performed testing, Arthrosamid® is considered biocompatible and suitable for long term contact with the body.
Materials used in Arthrosamid®

Biocompatibility of Arthrosamid®

The stability of Contura’s polyacrylamide hydrogels is described and discussed extensively in the Biological Evaluation Report (BER) – Arthrosamid®, and a summary of stability tests investigating potential hydrolysis, oxidative and physical stress on “Hydrogel B” is given below (Table 5). As reviewed in the BER, enzymatic degradation of polyacrylamide has been tested in various enzymatic fermentation systems, but no degradation was observed.
It is seen that the polyacrylamide hydrogel is stable and does not degrade under the test conditions.
View Stability and Lifetime Results

Stability and Lifetime of Arthrosamid®
As described in this and the previous sections, pre-clinical studies have shown that Arthrosamid®/”Hydrogel” is biocompatible, non-absorbable, non-biodegradable and non-migratory (Bello et al., 2007; Charles River, 2011; Zarini et al., 2004). Long-term clinical data has confirmed this (Mouritsen et al., 2014; Negredo et al., 2015). It is therefore reasonable to conclude that Arthrosamid® is stable and safe for the lifetime of the device.
The intended purpose of Arthrosamid® is summarised below:
| Intended purpose of Arthrosamid® | |
|---|---|
| Indication | Arthrosamid® is intended to be used for symptomatic treatment of knee osteoarthritis in adults. |
| Disease to be treated | Knee osteoarthritis. |
| Patient population | Adult patients diagnosed with osteoarthritis. |
| Intended application | Arthrosamid® is intended to be injected intra-articularly in the knee joint. |
| Intended user | Arthrosamid® is intended to be used by a qualified physician familiar with intra-articular injection procedures, such as orthopaedic surgeons or rheumatologists. |
| Effect on the human body | Arthrosamid® diminishes pain and improves function of the knee affected by osteoarthritis. |
| Tissues in contact with the device | Knee joint. |
| Duration of use | Long-term (>30 days). |
| Contact with mucosal membranes | Arthrosamid® is in contact with the synovial membrane of the knee joint. |
| Invasive / non-invasive | Invasive. |
| Implantable / non-implantable | Implantable. |
| Single use / reusable | Single use. |
| Recommended dose | 6 ml. |
| Contraindications | Arthrosamid® should not be injected:
|
| Warnings |
|
| Precautions required by the manufacturer |
|
Table 6. Intended purpose of Arthrosamid®. Twelve months clinical follow-up data is presented for Arthrosamid® (see 5.4.1 and 5.4.4), whereas long-term clinical data is available for Contura’s hydrogels for other indications for up to 8 or 10 years (3.1.2.10), and it is therefore reasonable to believe that this permanent implant/hydrogel is stable and safe for the lifetime of the device (3.1.2.10).The recommended dosage of 6 ml is based on the total volume of gel injected in the “proof-of-concept” study (2 x 3 ml for the majority (96%) of the patients) and on data from the CON-OA study (5.4.4). One injection of 6 ml compared to 2 x 3 ml reduces the risk of infection, and prophylactic antibiotics are only given once.
Pioneering, proven pain treatment for knee OA.
Contact us to use Arthrosamid® 2.5 iPAAG treatment in your knee osteoarthritis patients today.