Die Wissenschaft von Arthrosamid® (2.5 iPAAG)
Neudefinition der Behandlung von Kniearthrose, ohne Operation.

Neudefinition der Behandlung von Kniearthrose, ohne Operation.

Arthrosamid® ist ein nicht resorbierbares, nicht biologisch abbaubares, injizierbares, transparentes, hydrophiles Gel, das aus einem Rückgrat aus fest gebundenem, nicht biologisch abbaubarem Polyacrylamid (2,5%) und anhaftendem, nicht pyrogenem Wasser (97,5%) besteht
Arthrosamid® wird als vorgefüllte, sterile 1-ml-Spritze zum einmaligen Gebrauch geliefert, die mit einem Luer-Lock-Anschluss und einer Spitzenkappe verschlossen ist. Es ist für die intraartikuläre Injektion in das Kniegelenk mit einer sterilen 21G x 2 Zoll (0,8 x 50mm) Nadel vorgesehen.
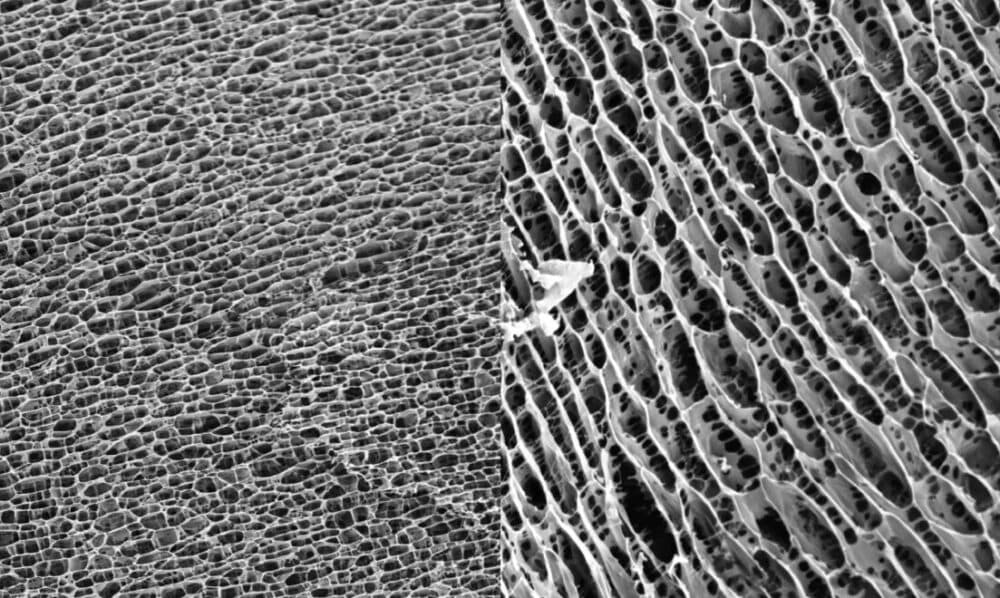
| Abbildung 1 zeigt die dreidimensionale Struktur des Polyacrylamid-Hydrogels. Die enge, gleichmäßige Wabenstruktur bietet eine Matrix für das Einwachsen von Zellen. |
Abbildung 2

Abbildung 3

Arthrosamid® enthält keine medizinischen Substanzen, Gewebe oder Blutprodukte.
Basierend auf den durchgeführten Tests gilt Arthrosamid® als biokompatibel und für den langfristigen Kontakt mit dem Körper geeignet.
In Arthrosamid® verwendete Materialien

Biokompatibilität von Arthrosamid®

Die Stabilität der Polyacrylamid-Hydrogele von Contura wird im Biological Evaluation Report (BER) – Arthrosamid® ausführlich beschrieben und diskutiert, und eine Zusammenfassung der Stabilitätstests zur Untersuchung potenzieller Hydrolyse-, oxidativer und physikalischer Belastungen von "Hydrogel B" ist unten aufgeführt (Tabelle 5). Wie in der GER überprüft, wurde der enzymatische Abbau von Polyacrylamid in verschiedenen enzymatischen Fermentationssystemen getestet, aber es wurde kein Abbau beobachtet.
Es zeigt sich, dass das Polyacrylamid-Hydrogel stabil ist und sich unter den Testbedingungen nicht abbaut.
Anzeigen von Stabilitäts- und Lebensdauerergebnissen

Stabilität und Lebensdauer von Arthrosamid®
Wie in diesem und den vorherigen Abschnitten beschrieben, haben präklinische Studien gezeigt, dass Arthrosamid®/"Hydrogel" biokompatibel, nicht resorbierbar, nicht biologisch abbaubar und nicht migratorisch ist (Bello et al., 2007; Charles River, 2011; Zarini et al., 2004). Klinische Langzeitdaten haben dies bestätigt (Mouritsen et al., 2014; Negredo et al., 2015). Es ist daher vernünftig zu schlussfolgern, dass Arthrosamid® während der gesamten Lebensdauer des Geräts stabil und sicher ist.
Der Verwendungszweck von Arthrosamid® ist im Folgenden zusammengefasst:
| Verwendungszweck von Arthrosamid® | |
|---|---|
| Indikation | Arthrosamid® soll zur symptomatischen Behandlung von Kniearthrose bei Erwachsenen eingesetzt werden. |
| Zu behandelnde Krankheit | Kniearthrose. |
| Patientenpopulation | Erwachsene Patienten, bei denen Arthrose diagnostiziert wurde. |
| Verwendungszweck | Arthrosamid® soll intraartikulär in das Kniegelenk injiziert werden. |
| Vorgesehener Benutzer | Arthrosamid® ist für die Anwendung durch einen qualifizierten Arzt bestimmt, der mit intraartikulären Injektionsverfahren vertraut ist, wie z. B. orthopädische Chirurgen oder Rheumatologen. |
| Wirkung auf den menschlichen Körper | Arthrosamid® lindert Schmerzen und verbessert die Funktion des von Arthrose betroffenen Knies. |
| Gewebe, die mit dem Gerät in Kontakt kommen | Kniegelenk. |
| Dauer der Nutzung | Langfristig (>30 Tage). |
| Kontakt mit Schleimhäuten | Arthrosamid® steht in Kontakt mit der Synovialmembran des Kniegelenks. |
| Invasiv / nicht-invasiv | Invasiv. |
| Implantierbar / nicht implantierbar | Implantierbar. |
| Einweg / wiederverwendbar | Einmaliger Gebrauch. |
| Empfohlene Dosis | 6 ml. |
| Kontraindikationen | Arthrosamid® darf nicht injiziert werden:
|
| Warnungen |
|
| Vom Hersteller geforderte Vorsichtsmaßnahmen |
|
Tabelle 6. Verwendungszweck von Arthrosamid®. Für Arthrosamid® liegen klinische Nachbeobachtungsdaten über zwölf Monate vor (siehe 5.4.1 und 5.4.4), während für die Hydrogele von Contura für andere Indikationen bis zu 8 oder 10 Jahre klinische Langzeitdaten vorliegen (3.1.2.10), und es ist daher vernünftig anzunehmen, dass dieses permanente Implantat/Hydrogel für die gesamte Lebensdauer des Produkts stabil und sicher ist (3.1.2.10).Die empfohlene Dosierung von 6 ml basiert auf dem Gesamtvolumen des in der "Proof-of-Concept"-Studie injizierten Gels ( 2 x 3 ml für die Mehrheit (96%) der Patienten) und auf Daten aus der CON-OA-Studie (5.4.4). Eine Injektion von 6 ml im Vergleich zu 2 x 3 ml reduziert das Infektionsrisiko, und prophylaktische Antibiotika werden nur einmal verabreicht.
Bahnbrechende, bewährte Schmerzbehandlung für Knie-OA.
Kontaktieren Sie uns, um Arthrosamid® noch heute bei Ihren Kniearthrose-Patienten einzusetzen.